診療・各部門
診療科からのメッセージ
診療は婦人科腫瘍専門医が行っております。
治療については、ガイドラインを基本にしつつ患者さんのご希望も考慮し、最も適切な医療を提示し実践してまいります。治療方針は病理診断がすべてであるといっても過言ではありません。そのため常日頃から、病理専門医と密接なやり取りを行い、総合的に診断し治療に対応いたします。さらに医療連携・患者相談支援センターと連携し、患者さんの支援を行ってまいります。
対象疾患
- 子宮腫瘍
良性:子宮頚部異形成、子宮頚管ポリープ、子宮内膜ポリープ、子宮筋腫、子宮腺筋症
悪性:子宮頸がん、子宮内膜がん、子宮肉腫 - 卵巣腫瘍
良性:卵巣嚢腫、卵巣内膜症性嚢胞
悪性:卵巣がん - 骨盤臓器脱
そのほか、更年期医療、性感染症、骨盤腹膜炎、月経不順、ピル処方、緊急避妊等にも対応しております。
医師プロフィール
池田 俊一
(いけだ しゅんいち)

部長
1986年 埼玉医科大学医学部卒
■ 専門領域
婦人科腫瘍
■ 資格
日本産科婦人科学会産婦人科専門医・指導医
日本婦人科腫瘍学会婦人科腫瘍専門医
日本臨床細胞学会細胞診専門医・教育研修指導医
日本がん治療認定医機構がん治療認定医
主たる診療内容と特色
当院は、婦人科領域において、良性疾患から前がん病変、さらにはがんの診断と治療まで幅広く専門的に対応しております。すべての女性が健やかな毎日を送れるよう、総合的に健康管理をサポートすることを目標としています。
- 婦人科腫瘍(悪性・良性)診断と治療
子宮頸癌、子宮体癌、卵巣癌、卵管癌、腹膜癌など
子宮筋腫、子宮腺筋症、卵巣嚢腫、APAMなど
- ホルモン療法
月経不順、月経前緊張症候群
子宮筋腫や子宮内膜症の内科的治療
月経移動
- 更年期治療
ホルモン補充療法
骨粗鬆症予防と治療
- 性感染症(STD)の診断と治療
特に、子宮頸部の前がん病変や将来の妊娠を希望される方の妊孕性(にんようせい)温存治療(子宮と卵巣、卵管を残す治療)に力を入れており、専門的かつ患者さま一人ひとりに合わせた医療を心がけています。
当院には、ヒトパピローマウイルス(HPV)感染をきっかけに受診される患者さまが特に多くいらっしゃいます。HPVは非常に一般的なウイルスで、性行為などの性的接触を経験した方の実に80%以上が生涯で一度は感染すると言われています。そのため、HPV感染は特別なことではなく、誰にでも起こりうる身近なウイルス感染症です
このような背景から、当院ではまず「HPV感染」について正しい知識を持っていただくことがとても重要と考えております。
■子宮頸がんとヒトパピローマウイルス(HPV)感染について■
子宮頸がんは、女性の子宮の入り口部分(子宮頸部)にできるがんで、その発症には「ヒトパピローマウイルス」、略してHPVと呼ばれるウイルスの感染が大きく関わっています。このHPVというウイルスはとても一般的で、多くの女性が一生のうちに一度は感染すると言われています。
HPVにはたくさんの種類がありますが、その中でも「ハイリスク型」と呼ばれる16型や18型という種類のウイルスが特に注意されています。これらの型は、子宮頸がんの約60%で検出されており、子宮頸がん発症の主な原因となっています。
HPVは子宮頸部の特に「扁平上皮」と「円柱上皮」という細胞が隣り合う「移行帯」という場所に感染します。感染したウイルスは、子宮頸部の細胞の一番奥、基底細胞の核の中に入り込み、「エピソーム」と呼ばれる形で存在します。エピソームとは、ウイルスがその細胞の中で独立して存在する形態のことです。
ほとんどの場合、私たちの体の免疫システムが働いて、数ヶ月から2年くらいの間にこのウイルスを排除してしまいます。これを「一過性感染」と言い、多くの人はこの段階で問題なく治っていきます。
しかし、約10〜20%の人はウイルスが基底細胞の核内で長期間とどまり続け、「持続感染」という状態になります。この持続感染は、がんになるリスクを高める重要な段階です。
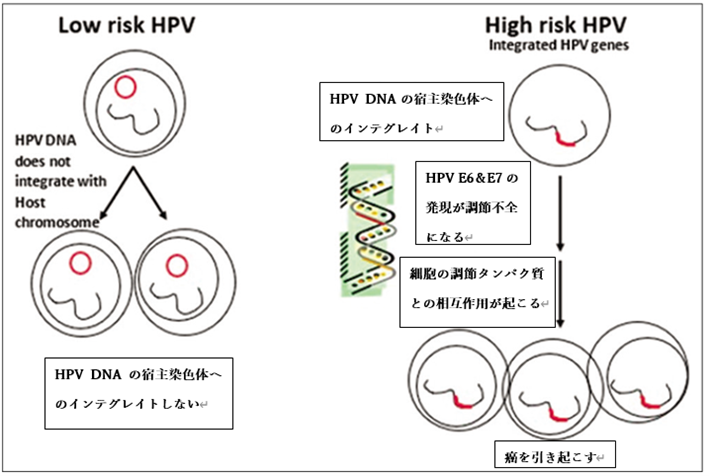
さらに持続感染の一部では、ウイルスのDNAが単に細胞内に存在し続けるだけではなく、「インテグレーション」と呼ばれる現象が起こり、ウイルスのDNAが細胞の染色体(私たちの遺伝子の本体)に物理的に組み込まれてしまいます。
この「インテグレーション」が特に問題で、ウイルスの中にある「E2遺伝子」という制御因子が壊されることが多く、このために「E6」や「E7」と呼ばれるウイルスの遺伝子の働きが活発になります。これらの遺伝子は私たちの細胞が本来持っているがん抑制遺伝子(特にp53やRbと呼ばれるタンパク質)の機能を妨げてしまいます。がん抑制遺伝子は、細胞の成長をコントロールし、異常な細胞増殖を防ぐ重要な役割を担っていますが、それが阻害されると細胞は制御不能に増殖を始め、遺伝子の安定性が失われやすくなります。そしてこれががん化の大きなステップとなるのです。
 最近の研究でも、このインテグレーションに伴い細胞のゲノム(遺伝情報)が大きく書き換えられたり、遺伝子のスイッチが変わったりする「エピジェネティック変化」が起き、これが子宮頸がんの進行に深く関わっていることが分かっています。
最近の研究でも、このインテグレーションに伴い細胞のゲノム(遺伝情報)が大きく書き換えられたり、遺伝子のスイッチが変わったりする「エピジェネティック変化」が起き、これが子宮頸がんの進行に深く関わっていることが分かっています。
初めてHPVが感染した時や感染が続いている早い段階では、主にエピソーム型と言われるウイルスの形態が多く見られます。このタイプのウイルスは免疫の力で比較的排除されやすいのですが、一旦遺伝子に組み込まれてしまう「インテグレート型」になると、ウイルスは宿主細胞に直接埋め込まれているため、免疫による排除が難しくなり、長期にわたり細胞の中に残りやすくなります。
専門家のまとめによると、インテグレーション型のHPVはがん抑制遺伝子の働きを崩して異常な細胞の増殖を促し、腫瘍形成を助けることが確認されています。対してエピソーム型はしばらくすると自然に消える傾向にありますが、インテグレーション型は消えにくく、がんへの進展リスクがより高いのです。
さらに、2025年の最新の研究では、特にインテグレーションの数が多く(例えば特定部位で40回以上の組み込みが確認される例)、ウイルスが長期間安定して存在している症例では、HPVの自然消失がほとんど見られず、その結果、子宮頸部の「HSIL(CIN2以上)」という前がん状態へ進みやすいことが報告されています。
こうした見地から、HPVが一度宿主(ひと)の遺伝子に組み込まれてしまうと自然に消えにくく、そのままがん化を促し続けることが分かっています。だからこそ、HPV感染の早い段階での適切な対策と、持続感染を予防することが、子宮頸がんを防ぐうえで非常に重要です。
子宮頸がんの予防には、HPVワクチン接種が非常に効果的で、多くのHPV感染そのものを防ぐことができます。しかし、ワクチンはすべてのハイリスク型HPVをカバーしているわけではありません。そのため、ワクチンを接種しても定期的な子宮頸がん検診を受けることはとても重要です。検診を通じて感染や異常を早期に発見し、適切な治療や経過観察を行うことが可能です。
日本では、CIN2以下のハイリスクHPV感染が見つかった場合、その約80~90%は2年以内に自然に消退するとされているため、経過観察となります。しかし、2年経ってもハイリスクHPVが消えない場合には、ウイルスのDNAが患者様自身の遺伝子に組み込まれてしまい、自然には消失せずにがんへと進行するリスクが高まります。繰り返しになりますが、このような「インテグレーション(組み込み)」が起こる割合は10~20%と決して少なくありません。
私たちは、このウイルスDNAがインテグレーションが起こす前、すなわち人の遺伝子に組み込まれる前に適切な治療を行うことが非常に重要だと考え、治療方針を立てて対応を行っています。
■子宮頸部のLSIL・HSIL:細胞診と組織診の違い■
1. 細胞診と組織診
1) 細胞診
子宮頸がん検診で最初に受ける一般的な検査です。子宮頸部の表面をやさしくこすり、はがれた「ばらばらの」細胞だけを集めて顕微鏡で調べます。
病変が広い範囲にあっても「一部の細胞」が流れ出していれば拾えますが、細胞の配列や範囲までは判断できません。
細胞診の異常の診断には、LSIL、HSIL、ASC-H、AGCなどの分類があります。
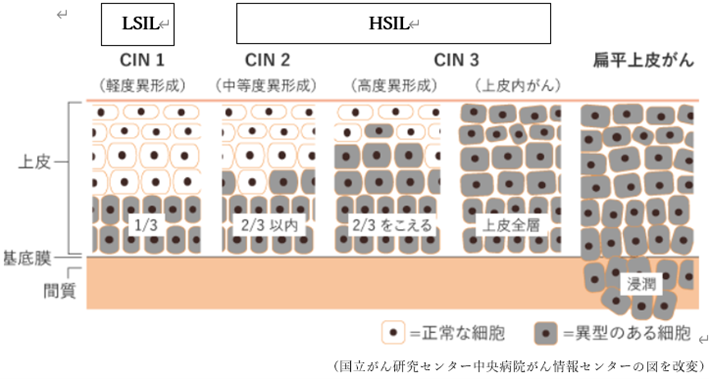
①LSILは「軽度扁平上皮内病変」といい、子宮頸部の表面の細胞に軽い異常がある状態を指します。この異常は多くの場合、ヒトパピローマウイルス(HPV)感染が原因で、細胞の形の一部が変化しているものの、その程度は軽く、体の免疫が働けば自然に治ることがほとんどです。したがって、LSILはがんそのものではなく、がんになる可能性も非常に低い状態とされています。通常は定期的な検査や経過観察を行い、場合によっては数か月後に再検査をして、異常が消えているか確認します。
②次にHSILは「高度扁平上皮内病変」と呼ばれ、LSILよりも細胞の異常が進んだ状態です。組織診ではCIN2~3(中等度~高度異形成)に相当し、病変は表面から深い部分まで及んでいます。細胞の形態の変化がより顕著で、がん化のリスクが高まっているため、放置せずにすぐに詳しい検査(コルポスコピーや組織診)を行い、必要に応じて治療を開始します。
③ASC-H(高度扁平上皮内病変を否定できない異型扁平上皮細胞)は、細胞診でHSILに近い異常が疑われるが明確な診断ができない状態です。組織診ではCIN2~3の高度病変が多く見つかりますが、一部は軽度の病変や正常の場合もあります。
④一方、AGC(異型腺細胞)は、子宮頸部や子宮体部の腺細胞(粘液を分泌する細胞)に異常があることを示します。組織診においては、頸管部の上皮内腺癌(AIS)や浸潤性腺癌、または良性の炎症変化などが見つかることもあり、多様な診断が考えられます。腺系の異常は広範囲かつ治療の必要性が高いため、コルポスコピーや頸管・内膜の検査を組み合わせて詳しく調べることが求められます。
⑤ほかにも細胞診にはASC-US(意義不明の軽度異型扁平上皮細胞)という分類があり、これは明確に良性とも悪性とも診断できない曖昧な状態を示します。組織診では軽度異形成(CIN1)や正常が多いですが、まれに進行形の病変が見つかることもあるため、HPV検査や再検査が推奨されます。
このように細胞診は子宮頸部の異常の有無や程度を“ざっくり”調べるスクリーニング検査の役割をもち、異常が疑われる場合は、二次検査として組織診が行われます。
2) 組織診
細胞診やHPV検査で異常が出た場合に、詳しく調べる「精密検査」として行います。コルポスコピーという拡大鏡で病変部を観察し、小さく(2~4mmほど)組織をつまんで採取します(コルポスコピー下生検)。細胞同士の“並び方”や“どのくらい広がっているか”、“深さ(表面からどこまで)”も詳細に調べ、診断の決め手になります。
まず、「LSIL」とは軽度扁平上皮内病変のことで、子宮頸部の細胞に軽い変化が見られる状態を指します。これは多くの場合、ヒトパピローマウイルス(HPV)感染が原因で起こるもので、体の免疫機能が働くことで自然に治ることがよくあります。そのため、LSILはがんではなく、がんになる可能性も非常に低いため、多くの患者さんは定期的に様子をみる経過観察で十分な状態です。
次に、「HSIL」は高度扁平上皮内病変と呼ばれ、LSILよりもさらに細胞の変化が進んだ状態を示しています。この段階は「がんになる一歩手前」と考えられており、そのまま放置すると、がんにつながるリスクが高いため、より詳しい検査や治療が必要になることが多いです。一般的に、病変の深さや広がりによっては円錐切除術などの治療が推奨され、早めに対応することでがん化を防ぐことが期待されます。
最後に、「AISとは「上皮内腺癌(Adenocarcinoma in situ)」の略称で、子宮頸部の腺細胞に異常が認められる前がん病変を指します。「上皮内」という言葉が示すように、がん細胞は上皮の中にとどまっており、まだ周囲の組織や他の部位には広がっていない状態です。ただし、AISは扁平上皮系と異なる特徴として「skip lesion(スキップ病変)」と呼ばれる性質があり、主要な病巣から離れた場所にも病変が現れることがあります。これは連続せず、離れた部分に病変が存在することを意味します。早期に発見すれば、AISは十分に治療効果が期待でき、適切な対応により完治が見込める状態です。
まとめると、LSILは軽度の細胞変化で自然治癒も期待できる状態であり、HSILはがんに進行する可能性が高い段階なので、精密検査や治療が必要です。AISは腺細胞での前がん病変であり、適切な治療によりほぼ治る段階だと言えます。どの場合もこれらは「がんそのもの」ではなく「がんになる前の段階」を表しているため、焦らずに医師の診療をしっかり受け、定期的な検査や必要な治療を行うことが大切です。
 2. LSIL・HSIL・AISを「庭の状態」でたとえると
2. LSIL・HSIL・AISを「庭の状態」でたとえると
①LSIL:庭に雑草の芽が出てきた状態
小さな雑草の芽がちょっとだけ出ている段階です。まだ成長はゆっくりで、簡単に引き抜けるので、ほうっておいても自然に枯れることもありますし、自分で抜くこともできます。つまり、体の免疫がウイルスをやっつけて自然に治りやすい段階です。
②HSIL:庭いっぱいに雑草が根をはりはじめている状態
雑草がすでに根を張って、放っておくと庭の花や植物まで傷んでしまう状態です。雑草は簡単には抜けなくなり、ちゃんと手入れ(治療)をしないと庭の植物がダメになってしまいます。
③AIS:土の中、花壇の深いところに強い根をもつ雑草が潜んでいる状態。
この雑草は、地表からは目立つ葉や茎があまり見えず、表面は一見きれいに見えても(コルポスコピーでは異常所見がなくても)、実は土の深い部分でしっかり根を張っています。根を完全に取り除いても、別の離れた場所で突然また芽が出てくることがあり(skip lesionといいます)、見た目だけで安心できないのが特徴です。
3. 細胞診と組織診で結果が違うこともある
細胞診は「表面の細胞」を調べるため、ごく初期の異常も拾いやすい一方、実際の組織では大きな異常がない場合もあります。
組織診は「病変部の状態」を立体的に確かめるので、細胞診でLSILでも組織診は正常、逆に細胞診でHSILでも組織診はLSILなど異なることがあります。
4.CIN3以上の病変は円錐切除を行う。
子宮頸部の疾患における妊孕性温存の手術については、円錐切除、そして子宮頸がんの場合には広汎性子宮頸部摘出術があります。
■子宮頸部円錐切除術の適応と術式■
子宮頸部円錐切除術は、子宮の入り口にあたる部分(子宮頸部)に異常があると疑われる場合や、異常な細胞の診断・治療が必要な場合に行われる手術です。この手術は、できる限り子宮を温存し、将来の妊娠や出産の可能性を残すことを重視しながら、確実に病変を取り除くことを目的としています。
1)適応される状況
この手術には主に診断目的と治療目的があります。
診断目的では、細胞診で異常が見つかっていても、その場所がコルポスコピーや組織診だけでははっきり特定できない場合や、がんが疑われるものの、進行度がわからない場合、ごく早期のがん(微小浸潤がん)でどれくらい広がっているかを詳しく調べる必要がある場合に適応されます。
治療目的の場合は、代表的にはHSILといった、がんにはなっていないものの将来的にがん化するリスクの高い病変、あるいはごく初期のがん(微小浸潤がん/Ia1期)でがんがごく浅く限られており、切除した断端に病変が及んでいないことが確認できる場合に行われます。また、今後の妊娠を希望しできるだけ子宮を残したい患者さんにも適した治療法です。
2)手術の流れ
全身麻酔で行われるため、手術中に痛みを感じることはありません。
術前にコルポスコピーで、病変の範囲を特定します。実際に切除する範囲は、病変以外に移行帯外側まで含めます。それはハイリスクHPVが感染する場所も含めて切除が必要と考えているからです。
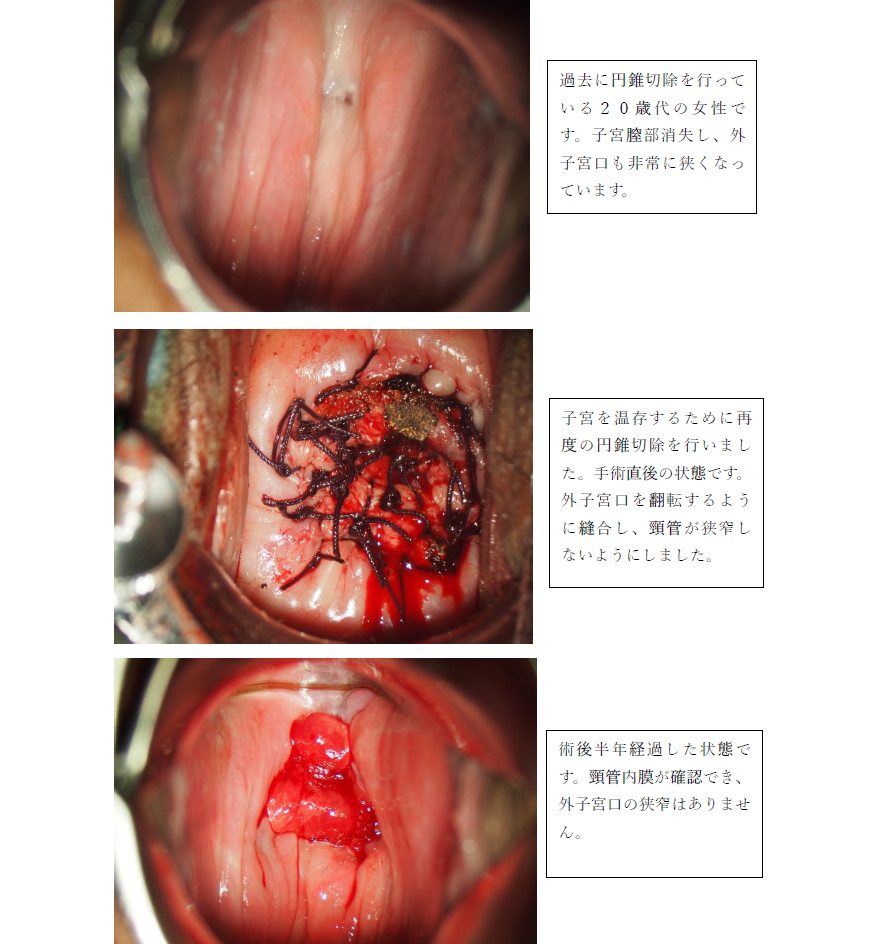
次に、通常のメスを使い、子宮頸部を円錐状に切り取ります。電気メス、レーザー、LEEPは切除断端が凝固変性し病理診断に差し支えがあることがあるため当院では用いません。切除した後の出血には子宮の出口(外子宮口を翻転するように縫合し、頸管が狭窄しないようにします。摘出した組織は病理検査に提出し、がんであるかどうか、進行具合や切除した端に病変が残っていないかなど、きめ細かな分析がされます。
手術翌日は退院で、その後は外来での経過観察となります。定期的に再発や合併症が起きていないかフォローアップすることが大切です。
3)手術の特徴と注意点
子宮頸部円錐切除術は子宮自体を温存できるため、妊娠や出産を望まれる方にも広く選ばれている治療法です。ただし、術後は子宮頸管が短くなることで流産や早産、頸管無力症のリスクがわずかに高くなることがあります。また、切除した断端部に病変が残っていた場合には追加治療が必要になることがあります。
4)円錐切除の主な合併症
1.術中・術後の出血について
術後の出血は創部が治るまで少量のものは皆さまが経験します。ここでいう出血は多量の出血です。100人手術をして2-3人に起こります。逆にいうと97-98%は大丈夫ということになります。出血は手術後10-14日くらいで突然発生します。子宮には多数の血管が存在します。クモの糸のような動脈もあり、子宮頸部の切除面を縫合、また電気メスで止血をするのですが、この目に見えないクモの糸のように細い動脈が手術終了後には血は止まっているのですが、切除断端が動脈の圧によって徐々に線香花火のように膨らみ破裂するのが10-14日後です。見えないクモの糸のように細い血管ですが、動脈のため断端が破裂すると驚くような出血を認めます。多く場合には、ガーゼ挿入で止血しますが、縫合が必要になることもあります。
2.子宮頚管(子宮の入口)が狭くなったり、塞がってしまうことについて
これもとても注意が必要な合併症です。手術の半年~数年後、または年をとってから(特に更年期以降)に起こることがあります。もし閉経前(生理がまだあるうち)に子宮の入口がふさがると、血がうまく外に出ず、卵管を通して逆流しお腹の中に血がたまってしまうこともあります。その場合、入院して治療が必要になることもあります。
閉経後に入口がせまくなっても、日常の生活に大きな影響はありませんが、子宮のがん検診ができなくなります。
子宮の入口が狭くなったり、ふさがってしまうことは、一生涯、付き合う必要が出てくる場合もあるので、医師としてもとても気をつかう点です。我々は、子宮の出口(外子宮口)を翻転するように縫合し、癒着しないように注意しながら縫合を行っております。
■広汎性トラケレクトミー(広汎性子宮頸部摘出術)■
広汎性トラケレクトミーは、子宮の入り口部分である子宮頸部だけを取り除き、子宮本体は温存する手術方法です。この手術の最大の特徴は、がんのごく早期の段階で行われることで、将来的に妊娠や出産を望む女性にとって非常に重要な選択肢となります。通常の子宮全摘出術とは異なり、子宮を残すため、身体的にも精神的にも負担を少なくしながらがんを治療できる可能性があります。
トラケレクトミーの適応はかなり限られています。まず、がんの進行度がごく初期であることが大前提です。当院では、まず円錐切除術を行い、取り除いた組織の病理検査(顕微鏡での詳しい検査)で、例えば癌の浸潤の程度が小さいことやリンパ管にがんが広く及んでいないことなどを確認したうえで、通常の扁平上皮がん・腺がんの場合に限ってこの手術を検討します。また、「子宮を残して将来妊娠を望む」というご希望を持つ方が、この手術の対象となります。
手術の方法についてですが、全身麻酔下に開腹手術で行われます。広汎性子宮全摘ができる医師であれば問題なく行える術式です。
手術では、両側卵管、卵巣は温存した状態で通常の広汎性子宮全摘術を行っていきます。膣に切開を入れ子宮を骨盤内で頸部を切除します。そして子宮体部と膣の一部は縫合され、子宮の機能が保たれるように再建されます。このため、患者様は将来にわたり妊娠・分娩が可能な状態を維持できることが多いのです。ただし、子宮頸部を切除することで、妊娠中の子宮頸管の強度が低下し、流産や早産のリスクが上がるため、妊娠時には産科医による慎重な管理が必要となります。
手術後の経過観察も重要で、再発の有無やリンパ節転移の兆候をみるために、定期的な検査や診察が行われます。これらのフォローアップを怠らないことで、早期発見と迅速な対応が可能になります。
広汎性トラケレクトミーは、適応基準をきちんと守ることで、治療効果と将来の妊娠・出産を両立できる大きな利点を持つ手術です。一方で、基準に合わない症例に安易に行ってしまうと、必要だったはずの子宮摘出を逃し、がんが再発・進行して生命にかかわる危険も生じます。したがって、この手術を選ぶ際には、ご自身の病状や手術のメリット・デメリットを十分に理解し、納得したうえで治療方針を決めることが大切です。
■婦人科癌の手術は開腹術か腹腔鏡手術か■
腹腔鏡手術の技術に優れた医師がいることは事実です。しかしすべての患者さまがそういった熟練医に担当してもらうことは現実的に難しいのが現状です。コクランレビューによると、良性疾患に対する場合、腹腔鏡下子宮全摘は、開腹手術と比べて尿管損傷のリスクが「2.6倍高い」と報告されています。より複雑な悪性疾患(がん)の手術となると、そのリスクはさらに高くなります。
そのため、がんの手術では「根治性」(病気をしっかり取りきること)の面からも、原則として開腹手術が望ましいと考えています。これにはいくつかの理由があり、以下に説明いたします。
①子宮頸癌
子宮頚がんに対する広汎性子宮全摘手術については、現時点で腹腔鏡手術ではなく開腹手術によって行うことが標準とされています。その理由は、これまで実施された国際的な大規模臨床試験(LACC試験)において、腹腔鏡やロボット支援による低侵襲手術群では再発率や死亡率が高くなり、開腹手術群のほうががんの治療成績で優れていることが明らかになったためです。これは、開腹手術のほうががんを確実に切除できること、そして手術中のリスク管理がしやすいことに起因しています。
また、LACC試験の結果を受けて、日本を含む多くの国の学会では広汎性子宮全摘の標準治療を開腹手術とし、低侵襲手術は標準治療とは認めていません。加えて、現在中国などアジア諸国をはじめ、世界各地で低侵襲手術と開腹手術の有効性や安全性を比較する前向き臨床試験や、LACC試験の内容をさらに追跡・解析するフォローアップ研究が進行中です。しかし、これらの新たな研究結果がそろうまでは、腹腔鏡手術による広汎性子宮全摘を標準治療として広く行うことはできません。現状では、"より安全に、がんを根こそぎ取りきれる"という点から、開腹手術が選択されています。
②子宮内膜癌
ESGO/ESTRO/ESPガイドライン(2023年)は、内膜癌に対して基本的に腹腔鏡手術(minimally invasive surgery, MIS)は低リスクおよび中間リスク症例に推奨されています。
高グレードの子宮内膜癌、特にG3や漿液性癌、明細胞癌などは予後が不良で筋層深部浸潤や微小転移の頻度が高く、腫瘍の根治的切除や十分なリンパ節郭清を達成するための技術的難易度が高いことが知られています。このため、欧州婦人科腫瘍学会(ESGO)、欧州放射線治療学会(ESTRO)、欧州病理学会(ESP)による最新のガイドラインでは、高リスクの高悪性度内膜癌は腹腔鏡といった低侵襲手術に一律に適応すべきではなく、慎重に適応を判断すべきと明記されています。具体的には、これらの高リスク症例では十分な外科的切除や広範囲のリンパ節郭清が必要となり、技術的な制約から腹腔鏡手術だけで根治性を確保するのは難しいこと、また腫瘍細胞の腹腔内播種のリスクも考慮されるため、開腹術や集学的治療が標準的に推奨されています。さらに、2022年頃の海外の総説論文でも高グレード内膜癌に対しては、腹腔鏡手術の選択には施設の熟練度や症例の適切な選択が不可欠であり、適応を誤ると再発リスク増加や不完全切除の危険があることが指摘されています。一方で、ESGO/ESTRO/ESPガイドラインでは可能な場合には腹腔鏡手術も検討されることがありますが、その表現は「if feasible(可能であれば)」と限定的であり、確固たる推奨とはなっていません。つまり、高グレード内膜癌では腹腔鏡手術は技術的・根治的な面から望ましい治療法とは言えず、安全かつ十分な治療効果を得るためには開腹術を含むより侵襲的な手術を基本とします。アメリカでも、子宮内膜癌の低リスク・中リスクでは腹腔鏡手術が「標準治療」として推奨されていますが、高リスク型・進行例ではESGO等ヨーロッパと同様に適応慎重です(根治性、安全性最優先)。
③卵巣がん
現時点の国際的な医学研究結果を踏まえると、早期卵巣がん(主にFIGOステージIなど限局例)に対し、腹腔鏡手術が開腹術と比較して根治性(十分な腫瘍切除・再発管理)や予後成績で同等であると示した「無作為化比較試験(RCT)」は存在しません。
多くのシステマティックレビューやメタ解析、後ろ向き観察研究、Propensity score matching研究では「腹腔鏡手術は開腹手術に比べて、術後回復・合併症・入院期間の短さなど周術期成績においては優れるが、根本的な予後(再発・生存率)については“差がない”、もしくは“症例選択次第で同等となる”」と報告されています。しかしいずれも無作為化比較ではなく後ろ向き・観察研究がほとんどであり、エビデンスレベルは限定的です。
たとえば2022年の大規模観察研究や2023年のメタ解析でも「腹腔鏡手術と開腹手術で無再発生存率や全生存率は差がなかった」とされていますが、「RCTによる直接比較」「長期の予後評価」を満たすレベルには達していません。2016年のコクランレビューや2022年の系統的レビューでも「RCTは不在」「今後RCTが必須」と明言されています。
■良性疾患で子宮摘出が必要な場合■
良性疾患で子宮を摘出する必要がある場合、私たちは基本的には「膣式子宮全摘術(ちつしきしきゅうぜんてきじゅつ)」という、お腹を切らずに膣から子宮を取り出す手術を第一選択としています。
医学的にしっかり裏付けのある情報として、世界中の臨床試験データを集めて分析している「コクランレビュー」の報告によると、腹腔鏡を使った子宮摘出は、膣式と比べて膀胱や尿管の損傷リスクが高くなることがわかっています。そのためコクランレビューでは、膣式子宮全摘術(場合によって腹腔鏡の補助も含めて)を勧めています。
この手術は体への負担が少なく、開腹手術に比べて回復がとても速いのが特徴です。術後も早ければ翌日にも退院できそうなほど回復されていますが、念のため手術の翌々日に退院していただいております。
また、子宮脱の患者様では下がっている子宮と一緒に卵巣や卵管も同時に摘出できますが、子宮が下がっていない場合は卵巣や卵管だけ摘出するのは困難です。しかし最近では、「vNOTES(ヴイノーツ)」という経膣的腹腔鏡手術の技術を使うことで、膣から卵巣や卵管も安全に取り出せるようになりました。当院でも、必要な場合は膣式子宮全摘に引き続いてvNOTESという方法で卵巣や卵管を摘出する手術に取り組んでいます。